
Gaz Basıncı Genel Özellikleri
Gazların basıncı, fiziksel ve mühendislik alanlarında önemli bir yer tutar. Moleküllerin hareketiyle oluşan bu basınç, sıcaklık, hacim ve gaz miktarı gibi faktörlerden etkilenir. Ölçüm yöntemleri ve çeşitli uygulama alanları, gaz basıncının önemini ortaya koymaktadır.
Gazların, belirli bir hacim ve sıcaklık altında sahip olduğu basınç, fiziksel ve mühendislik alanlarında önemli bir konu teşkil etmektedir. Gaz basıncı, gaz moleküllerinin hareketi ve çarpışmaları sonucu ortaya çıkan bir kuvvet olarak tanımlanabilir. Bu makalede, gaz basıncının genel özellikleri, ölçüm yöntemleri, etkileyen faktörler ve uygulama alanları ele alınacaktır. Gaz Basıncı Nedir?Gaz basıncı, bir gazın belirli bir yüzeye uyguladığı kuvvetin, o yüzeyin alanına oranı olarak tanımlanır. Gaz molekülleri, sıcaklık ve enerji durumlarına bağlı olarak sürekli bir hareket halindedir. Bu hareket sırasında, moleküller yüzeylere çarparak basınç oluştururlar. Gaz Basıncını Etkileyen Faktörler Gaz basıncını etkileyen başlıca faktörler şunlardır:
Gaz Basıncı Ölçüm Yöntemleri Gaz basıncını ölçmek için çeşitli yöntemler ve cihazlar kullanılmaktadır. Bunlar arasında:
Gaz Basıncının Uygulama Alanları Gaz basıncı, birçok endüstriyel ve bilimsel uygulamada kritik bir öneme sahiptir. Öne çıkan bazı alanlar şunlardır:
Sonuç Gaz basıncı, fiziksel ve mühendislik alanlarında temel bir kavramdır. Sıcaklık, hacim ve gaz miktarı gibi faktörlerin etkisi altında değişiklik gösterir. Ölçüm yöntemleri ve uygulama alanları, gaz basıncının önemini bir kez daha vurgulamaktadır. Gelecekte, gaz basıncının daha iyi anlaşılması ve kontrol edilmesi, birçok teknolojik gelişmeye zemin hazırlayabilir. Ekstra Bilgiler Gaz basıncının hesaplanmasında kullanılan bazı temel formüller şunlardır:
Bu bilgiler, gaz basıncının genel özellikleri ve uygulamaları hakkında daha derin bir anlayış geliştirmek için önemlidir. Gaz basıncı üzerine yapılacak daha fazla araştırma, enerji verimliliği ve çevresel sürdürülebilirlik gibi konulara katkıda bulunabilir. |
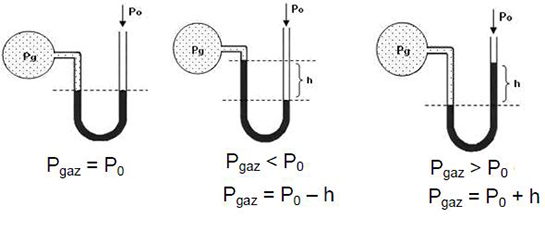






































Gaz basıncı nelere bağlıdır? Hacim, sıcaklık ve molekül sayısı gibi faktörler gaz basıncını etkileyen temel unsurlar arasında yer alır. Özellikle Boyle-Mariotte kanunu ve Gay-Lussac kanunu bu ilişkileri net bir şekilde açıklar. Gazın hacmi azaldıkça basıncın arttığı, sıcaklık arttıkça ise basıncın da arttığı gözlemlenmektedir. Aynı zamanda, gazın içinde bulunduğu ortamın sıcaklık ve nem durumu da basıncı etkileyen önemli etkenlerdendir. Bu durumların hepsi, gazların davranışlarını anlamak için kritik öneme sahiptir.
Sayın İfakat,
Gaz Basıncının Temel Faktörleri konusunda yaptığınız tespitler oldukça doğru. Gaz basıncının hacim, sıcaklık ve molekül sayısı gibi değişkenlerle ilişkisi, gazların fiziksel özelliklerini anlamak açısından büyük önem taşımaktadır.
Boyle-Mariotte Kanunu ve Gay-Lussac Kanunu gibi temel fiziksel yasalar, gazların davranışlarını matematiksel bir çerçeve içinde incelememizi sağlar. Özellikle Boyle-Mariotte Kanunu, hacim ile basınç arasındaki ters orantıyı açıkça ortaya koyarken, Gay-Lussac Kanunu sıcaklık ile basınç arasındaki doğrudan ilişkiyi gösterir.
Ayrıca, Ortamın Sıcaklık ve Nem Durumu da gazların basıncı üzerinde önemli bir etkiye sahiptir. Sıcak havalarda gaz molekülleri daha fazla enerjiye sahip olduğundan, çarpışma sıklığı artmakta ve bu durum basıncı yükseltmektedir. Nem ise, gazın yoğunluğunu etkileyerek dolaylı yoldan basıncı değiştirebilir.
Sonuç olarak, gazların davranışlarını ve basıncını etkileyen bu faktörler, fiziksel bilimler açısından kritik bir öneme sahiptir. Yorumunuzda bu noktaları açıkça belirtmeniz, konunun anlaşılmasına yardımcı olmuş. Teşekkür ederim.
Gaz basıncı ile ilgili bilgiler oldukça ilginç. Özellikle açık hava basıncının cıva ile yapılan deneyle ölçülmesi ve Torricelli'nin bu konudaki katkıları beni etkiledi. Deniz seviyesindeki cıva yüksekliğinin 76 cmHg olması, basınç ile ilgili kavramları daha iyi anlamamı sağlıyor. Hava basıncının deniz seviyesinden yükseklere çıkıldıkça azalması da önemli bir nokta. Bu durum, dağcılık gibi yükseklik değişimlerinin yaşandığı aktivitelerde yaşanan basınç değişimlerini anlamamıza yardımcı oluyor. Boyle-Mariotte kanunu ve Gay-Lussac kanunu arasındaki ilişki de dikkat çekici. Sıcaklık ve hacim arasındaki bu ters orantı, gazların davranışını anlamak için önemli bir temel oluşturuyor. Özellikle sıcaklık değişimlerinin gaz basıncını nasıl etkilediğini bilmek, günlük hayatta karşılaştığımız birçok durumu açıklayabilir. Son olarak, ideal gaz yasası ile ilgili verdiğiniz bilgiler bilimsel bir bakış açısıyla gazların davranışlarını anlamamı sağlıyor. Bu denklemin pratikte nasıl kullanıldığını merak ediyorum. Gazların davranışlarını daha iyi anlamak için hangi durumlarda bu yasaların geçerli olduğunu bilmek önemli olabilir mi?
Gaz Basıncı ve Torricelli'nin Katkıları
Özdoruk, gaz basıncı ile ilgili paylaşımlarınız gerçekten ilgi çekici. Torricelli'nin cıva ile yaptığı deney ve deniz seviyesindeki cıva yüksekliği, hava basıncının somut bir örneği olarak akılda kalıcıdır. Bu tür deneyler, basınç kavramını daha iyi kavrayabilmemiz açısından son derece faydalı.
Yükseklik ve Hava Basıncı
Yükseklik arttıkça hava basıncının azalması, dağcılık gibi aktivitelerde önemli bir faktördür. Bu durum, insan vücudunun nasıl etkilendiğini anlamamızda büyük rol oynar. Özellikle yükseklere çıkıldıkça oksijen azalması, sporcuların performansını etkileyebilir.
Boyle-Mariotte ve Gay-Lussac Kanunları
Boyle-Mariotte kanunu ile Gay-Lussac kanunu arasındaki ilişki, gazların davranışını anlamak açısından kritik bir öneme sahiptir. Sıcaklık ve hacim arasındaki ters orantı, günlük yaşamda karşılaştığımız pek çok olayı açıklamaya yardımcı olabilir.
İdeal Gaz Yasası
İdeal gaz yasasının pratikte nasıl kullanıldığı, gazların davranışlarını anlamak için önemli bir konudur. Bu yasa, özellikle düşük basınç ve yüksek sıcaklık koşullarında geçerlidir. Gazların hangi durumlarda ideal davrandığını bilmek, mühendislik ve bilimsel çalışmalarda büyük önem taşır. Örneğin, mühendislik alanında gazların hesaplamalarında bu yasayı kullanmak, sistemlerin verimli çalışmasını sağlamakta kritik bir rol oynar.