
Maddenin Gaz Hali
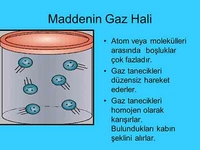
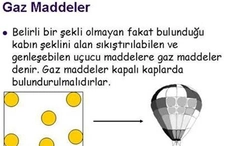
Gazlar, maddenin fiziksel ve kimyasal özellikleriyle belirlenen önemli bir halidir. Belirli bir şekil ve hacme sahip olmadan, bulundukları kabın şeklini alarak özgürce hareket ederler. Gazların moleküler yapısı ve etkileşimleri, yoğunluk, basınç ve sıcaklık gibi temel özellikleri üzerinde etkili olur.
Maddenin gaz hali, maddenin üç temel hâldan biri olan gazların fiziksel ve kimyasal özelliklerini ifade eder. Gazlar, belirli bir şekil ve hacme sahip olmadan bulundukları kabın şeklini alabilirler. Bu özellikleri, gazların moleküler yapısı ve etkileşimleri ile doğrudan ilişkilidir. Gazların Temel Özellikleri Gazların fiziksel özellikleri, aşağıdaki gibi sıralanabilir:
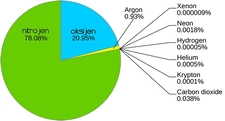
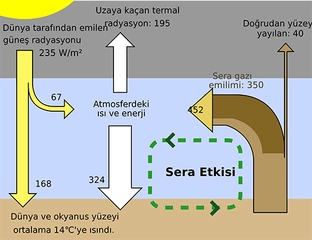
Moleküler Yapı ve Etkileşimler Gazların moleküler yapısı, atmosferdeki gazların ve endüstriyel gazların özelliklerini belirler. Gaz molekülleri arasındaki etkileşimler zayıf olduğundan, gazlar birbirleriyle kolayca karışabilir. Gazların moleküler yapısı ve etkileşimleri hakkında daha fazla bilgi:
Gazların Durum Denklemleri Gazların davranışını açıklamak için çeşitli durum denklemleri kullanılır. En yaygın olanları arasında ideal gaz denklemi bulunmaktadır:
Gazların Uygulamaları Gazlar, birçok endüstriyel ve günlük uygulamada kritik bir rol oynar. Öne çıkan bazı alanlar şunlardır:
Sonuç Maddenin gaz hali, fiziksel ve kimyasal özellikleri ile birçok alanda önemli bir yere sahiptir. Gazların davranışlarını anlamak, hem günlük yaşamda hem de endüstriyel uygulamalarda kritik öneme sahiptir. Gazların özellikleri ve etkileşimleri, bilimin ve teknolojinin ilerlemesine katkıda bulunmuş ve birçok yeniliğin temelini oluşturmuştur. Ekstra Bilgiler Gazların özellikleri hakkında bazı önemli noktalar:
Bu makalede, maddenin gaz hali ile ilgili temel bilgiler sunulmuştur. Gazların özellikleri, davranışları ve uygulamaları hakkında daha fazla bilgi edinmek, bilimsel araştırmalar ve uygulamalar için önemlidir. |







































Gazların davranışları hakkında yazdıklarınızı okuduktan sonra aklımda bazı sorular oluştu. Gazların katı ve sıvı hallerine göre hacimlerinin çok daha değişken olduğunu belirtiyorsunuz. Peki, bu gazların hacminin sıcaklık ve basınca bağlı olarak nasıl değiştiği ile ilgili günlük hayatta hangi örnekleri verebiliriz? Özellikle sıcaklık değişimlerinin gazların hacimlerini nasıl etkilediğini merak ediyorum. Ayrıca, gazların esnek çarpışmaları sırasında enerji geçişinin nasıl gerçekleştiği konusunda daha fazla bilgi alabilir miyim?
Eda naz, soruların oldukça ilginç ve günlük hayatta sıkça karşılaşabileceğimiz konulara değiniyor. Gazların hacminin sıcaklık ve basınca bağlı olarak nasıl değiştiğini anlamak, birçok durumu açıklamakta yardımcı olabilir.
Sıcaklık ve Hacim İlişkisi
Gazların hacmi, sıcaklık arttıkça genellikle artar. Bu durumu örneklerle açıklamak gerekirse; bir hava balonunu düşünelim. Hava balonunu ısıttığımızda içindeki hava genişler ve balonun hacmi artar. Bu, gazların moleküllerinin sıcaklık arttıkça daha hızlı hareket etmesi ve dolayısıyla daha fazla yer kaplamasıyla ilgilidir. Diğer bir örnek ise, yaz aylarında otomobilin içinde bırakılan bir teneke kutunun patlamasıdır. Sıcak havada gazların hacmi artar ve basınç yükselir, bu da kutunun patlamasına yol açabilir.
Basınç ve Hacim İlişkisi
Basınç arttıkça, gazın hacmi genellikle azalır. Bu durumu örneklendirmek için bir pompa ile bisiklet lastiğini düşünelim. Lastiğe hava pompaladıkça, içindeki gazın hacmi azalır, çünkü basınç artar. Bu ilişki, Boyle'un yasasıyla açıklanır: Sabit sıcaklıkta bir gazın hacmi, üzerindeki basınç ile ters orantılıdır.
Gazların Esnek Çarpışmaları ve Enerji Geçişi
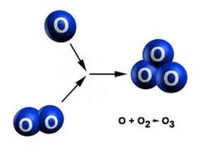
Gaz molekülleri birbirleriyle esnek çarpışmalar yaparlar. Bu çarpışmalar sırasında, moleküller arasında kinetik enerji transferi gerçekleşir. Örneğin, bir gaz molekülü diğerine çarptığında, çarpışma esnek olduğundan, toplam enerji korunur ancak moleküllerin hızları değişebilir. Bu, gazın sıcaklığını etkileyen bir faktördür. Moleküllerin daha hızlı hareket etmesi, gazın sıcaklığının arttığını gösterir.
Bu bilgiler ışığında, gazların davranışları günlük yaşamımızda birçok örnekle karşımıza çıkmaktadır ve bu durumları daha iyi anlayabilmek, çeşitli uygulamalarda bize yardımcı olabilir.